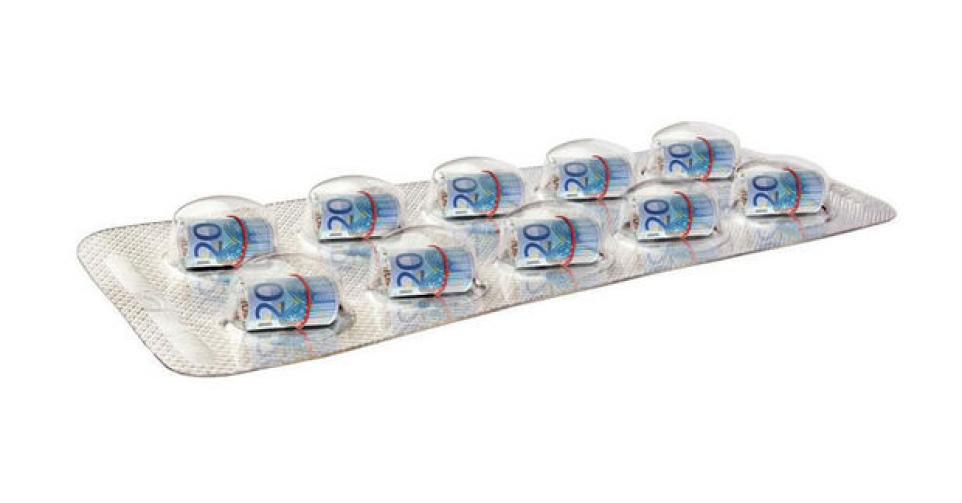
De woekerprijs van een zeldzame ziekte: hoe een medicijn plots 500 keer duurder werd

Als businessplan is het even lucratief als cynisch: koop de rechten op een goedkoop geneesmiddel dat toevallig blijkt te helpen bij een zeldzame ziekte, verhoog de prijs met factor 500 en blok de concurrentie af. De patiënt, om wie het hoort te draaien, gaat eraan kapot. Dit is het verhaal van Lucas.
Lucas (*) was nog maar een jonge tiener toen hij een een zware epileptische aanval kreeg, schijnbaar uit het niets. ‘Epilepsie is altijd een symptoom van een onderliggende ziekte, vertelde de neuroloog bij wie we met Lucas terechtkwamen’, herinnert zijn moeder zich. Maar de onderliggende oorzaak werd niet meteen gevonden, en in de daaropvolgende jaren ging het langzaam bergaf met hem. Studeren ging steeds moeizamer, na een veelbelovende start. Nadien op het werk vlotte het ook almaar minder. Lucas trouwde en kreeg een kind, maar zijn huwelijk liep op de klippen en hij verloor zijn baan. Tot overmaat van ramp moest hij om medische redenen zijn auto en rijbewijs inleveren. Zijn ouders ontfermden zich weer over hem. ‘Het viel ons op dat hij zo vreemd stapte’, vertelt zijn moeder. ‘Lucas liep verscheidene breuken op bij valpartijen. De ene keer brak hij een enkel, een andere keer viel hij door een glazen douchewand. En hij gedroeg zich raar, ontremd, net als een puber.’
De kostprijs van CDCA steeg van 308 naar 153.000 euro per jaar.
Zijn arts dacht aan een mogelijke stofwisselingsziekte, maar zat aanvankelijk op een verkeerd spoor. ‘Pas toen de pezen aan Lucas’ voeten opvallend verdikten en hij steeds minder mobiel werd en meer gedragsstoornissen vertoonde, werd de diagnose cerebrotendineuze xanthomatose (CTX) gesteld, een zeer zeldzame stofwisselingsziekte.’
Zoals Lucas zijn er een tiental patiënten in België en ongeveer 60 in Nederland. Wereldwijd zijn er meer dan 300 beschreven, maar de ziekte zou voorkomen bij één op de 50.000 mensen. De oorzaak zit in een genetische mutatie.
Het probleem zit bij de synthese van galzuren – die zijn nodig voor de spijsvertering -, waarbij te veel van het bijproduct cholestanol gevormd wordt. Cholestanol is een giftig vet dat zich overal kan opstapelen in het lichaam, en met de jaren steeds meer schade aanricht. De eerste symptomen kunnen al bij borelingen opduiken, met chronische diarree en knobbels op de pezen. Driekwart ontwikkelt tijdens de kindertijd cataract. Zowat alle organen kunnen getroffen worden, maar gangstoornissen, hersenaantasting met ziekten als epilepsie, parkinsonisme, zeer vroegtijdige dementie en psychiatrische aandoeningen zijn de ergste uitingen.
Omdat CTX zo zeldzaam is, duurt het soms lang voordat de diagnose gesteld wordt. Een DNA-onderzoek biedt zekerheid. ‘Hoe sneller de diagnose gesteld wordt, hoe beter, want er bestaat wel degelijk een medicijn dat CTX tot stilstand brengt’, zegt professor David Cassiman, expert in stofwisselingsziekten van het UZ Leuven. ‘Patiënten moeten het levenslang dagelijks innemen. Zo niet evolueren ze snel naar zware verwikkelingen en handicaps.’
Het zijn pijnlijk ware woorden.
500 keer duurder
Soms neemt de geneeskunde een omweggetje. In de jaren 1970 ontwikkelde de Duitse arts-apotheker Herbert Falk, van Dr. Falk Pharma, een middel om galstenen op te lossen op basis van chenodeoxycholzuur (CDCA), een substantie die wordt gewonnen uit gal van dieren. CDCA wordt dan gezuiverd en in capsules gestopt. Het effect van dit medicijn, dat onder de merknaam Chenofalk op de markt kwam, bleek ondermaats.
Maar omdat een gestoorde galhuishouding ook centraal staat bij CTX, werd Chenofalk ook op CTX-patiënten getest. Met veel succes, zo bleek: het middel kan het voortschrijden van de ziekte zo goed als stoppen. Vanaf de jaren negentig werden de capsules ‘off-label’ voorgeschreven aan CTX-patiënten, wat betekent dat de indicatie niet in de bijsluiter staat. Kostprijs voor de patiënt, in die tijd: 308 euro per jaar.
Om ervoor te zorgen dat patiënten met zeldzame ziekten niet in de kou blijven staan, werd het statuut ‘weesgeneesmiddel’ bedacht.
Het Duitse bedrijf Dr. Falk Pharma, dat Chenofalk in portefeuille had, zag af van de kosten om de nieuwe indicatie te laten registreren. De beslissing zou verregaande gevolgen hebben. In 2008 kocht het Italiaanse farmabedrijfje Sigma-Tau Pharmaceuticals de rechten op Chenofalk op. In 2015 haalde het het middel van de markt. Ook alle concurrerende producten werden opgekocht, waaronder Chenix van het Belgische Solvay, en van de markt gehaald. Alles paste in de bedrijfsstrategie: Sigma-Tau wilde de galmolecule laten registreren voor de zeldzame ziekte CTX. De aanvraag daartoe werd in 2016 goedgekeurd door het Europees Geneesmiddelen Agentschap (EMA). CDCA kreeg daarmee een gewild statuut: dat van weesgeneesmiddel. Sigma-Tau veranderde zijn naam in Leadiant Biosciences, en lanceerde in 2017 chenodeoxychol- zuur onder de naam ‘CDCA Leadiant’. Kostprijs voor de patiënt: 153.000 euro per jaar. 500 keer meer dan enkele jaren voordien.
Weesgeneesmiddel? Dat zit zo. Onderzoek naar geneesmiddelen voor zeldzame, ernstige ziekten is vaak niet rendabel voor de farmaceutische sector. De ontwikkeling vraagt dikwijls zware investeringen, terwijl er amper return is door de zeer beperkte afzetmarkt. Om ervoor te zorgen dat patiënten met zeldzame ziekten niet in de kou blijven staan, werd het statuut ‘weesgeneesmiddel’ bedacht. Het wordt toegekend aan farmaceutische producten die een belangrijk voordeel bieden aan patiënten met een zeer ernstige ziekte die minder dan één op de 2000 mensen in de EU treft. De bedrijven in kwestie worden gestimuleerd op basis van de Europese Verordening inzake Weesgeneesmiddelen. De firma die het middel in de markt zet, krijgt gedurende tien jaar een monopolie op het medicijn in Europa.
‘Sinds 2000 zijn er meer dan 140 weesgeneesmiddelen bijgekomen’, zegt professor Cassiman. ‘Vaak gaat het om vernieuwende medicijnen die zeer belangrijk zijn voor mensen met zeldzame ziekten. Meer dan de helft van deze middelen wordt ontwikkeld door kleine bedrijven die dankzij de Europese bescherming en steun volop inzetten op weesgeneesmiddelen. Het levert veel op, en er zijn zelden problemen mee.’
Achterpoortje
De Europese Verordening inzake Weesgeneesmiddelen is niet waterdicht. ‘Deze regelgeving laat toe dat je bekende medicijnen mag hergebruiken voor zeldzame ziekten als ze zich daartoe zouden lenen, zonder dat je veel nieuw onderzoek doet’, zegt de Nederlandse arts-epidemioloog Wilbert Bannenberg. ‘Dat maakt misbruiken mogelijk. Je hebt nauwelijks ontwikkelkosten en kunt toch een hoge prijs vragen. Dat is misschien legaal, maar die sluiproute zou gesloten moeten worden.’
Deze regelgeving laat toe dat je bekende medicijnen mag hergebruiken voor zeldzame ziekten als ze zich daartoe zouden lenen, zonder dat je veel nieuw onderzoek doet.
Bannenberg richtte afgelopen zomer de Stichting Farma ter Verantwoording op, bestaande uit artsen en juristen. ‘Onze Stichting wil erop toezien dat geneesmiddelen en andere medische technologieën op een duurzame wijze beschikbaar zijn op de markt’, klinkt het. ‘Wij vinden de handelswijze van Leadiant maatschappelijk onbetamelijk.’
Leadiant maakte gebruik van het achterpoortje in de Europese Verordening om gedurende tien jaar de Europese marktrechten te verwerven voor CDCA. Bij haar aanvraag recupereerde de firma CTX-studies die artsen de voorbije jaren wereldwijd hadden uitgevoerd, en verzamelde ze resultaten van de behandeling van CTX-patiënten met de oude, goedkope versie van hetzelfde medicijn. Eigen onderzoek was er nauwelijks. De prijsverhoging is grotendeels winst. ‘Onze stichting berekende dat de prijs voor CDCA in tien jaar tijd steeg van 0,28 euro naar 140 euro per capsule’, zegt Bannenberg. Veel patiënten hebben drie capsules per dag nodig, en dat levenslang.
De Stichting Farma ter Verantwoording diende op 7 september bij de Nederlandse mededingingsautoriteit ACM een verzoek in om op te treden tegen Leadiant wegens misbruik van zijn economische machtspositie.
Gevraagd om een wederwoord liet Leadiant aan Knack weten dat het ‘geen tijd had om te reageren’.
Tegenzet
Nadat alle betaalbare CDCA van de Europese markt verdwenen was, besloten ziekenhuizen waar CTX-patiënten in behandeling waren alle mogelijke specialiteiten van buiten Europa te importeren, tot Japan toe. Toen ook die producten niet meer verkrijgbaar waren, begonnen sommige ziekenhuisapothekers zelf capsules te bereiden – de extreem dure capsules van Leadiant waren op dat moment nog niet op de markt. Onder hen de hoofd-ziekenhuisapotheker Thomas De Rijdt van UZ Leuven: ‘Wij kochten de grondstof aan bij een Nederlands bedrijf (Euro Chemicals, nvdr), dat ze met een analysecertificaat aanleverde. Het bedrijf kocht het zelf aan bij een Chinese fabrikant, die over een “good manufacturing practice”-certificaat beschikt, wat betekent dat het aan strikte kwaliteitseisen voldoet.’
Wij vinden de handelswijze van Leadiant maatschappelijk onbetamelijk.’ Stichting Farma ter Verantwoording
De voorbije jaren maakte behalve de ziekenhuisapotheek van het UZ Leuven ook die van het UZ Antwerpen en die van het Academisch Medisch Centrum in Amsterdam CDCA-capsules voor CTX-patiënten. ‘De beschikbaarheid en de continuïteit van de medicatie is van levensbelang’, benadrukt De Rijdt. Er kan al onomkeerbare schade optreden wanneer de behandeling langer dan drie maanden wordt gestaakt. Dankzij de bereiding kostte een CDCA-behandeling nog 25.000 euro per patiënt per jaar. In België werden die kosten grotendeels vergoed door het Bijzonder Solidariteitsfonds.
De magistraal bereide CDCA was al gauw een doorn in het oog van Leadiant. ‘De firma beklaagde zich er op 18 mei over bij de Nederlandse Inspectie’, zegt Wilbert Bannenberg. ‘De bereide CDCA-capsules werden opgevraagd en geanalyseerd. De capsules uit AMC Amsterdam bevatten volgens een rapport van de Inspectie Gezondheidszorg en Jeugd onzuiverheden in de grondstof die boven de limiet van de Europese farmacopee vallen.’ Volgens die farmacopee, een officieel handboek met voorschriften voor de analyse van geneesmiddelen, mag de grondstof slechts minimale hoeveelheden galzuur-gerelateerde onzuiverheden bevatten. De Nederlandse Zorginspectie oordeelde dat het ziekenhuis de capsules moest ’terugroepen’ bij de CTX-patiënten. Nochtans is het helemaal niet onlogisch dat een galproduct van dierlijke afkomst onzuiverheden bevat. Het merkproduct van Leadiant bevat volgens een rapport van het Europees Geneesmiddelen Agentschap ook onzuiverheden, die door de fabrikant zijn geïdentificeerd maar door het Agentschap niet onveilig zijn bevonden.
‘Onrechtvaardig’
Kort na de Nederlandse terugroeping ging de bal ook aan het rollen voor het UZ Leuven en het UZ Antwerpen. ‘Het Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten (FAGG) kreeg van zijn Nederlandse evenknie de vraag om de grondstof van Euro Chemicals te laten analyseren, en stelde ook onzuiverheden vast’, zegt David Cassiman. ‘Nochtans beschikken de bereidende ziekenhuisapotheken over een analysecertificaat van een door de overheid erkend laboratorium’, vult De Rijdt aan. ‘Eerst moesten de resterende capsules “in quarantaine” in het UZ Leuven, vervolgens in het UZ Antwerpen, en tot slot kregen de patiënten een brief met de boodschap dat hun medicatie verplicht werd teruggeroepen.’
De therapie van Leadiant is voor de patiënten en hun families onbetaalbaar. Er loopt nu een aanvraag tot vergoeding bij het Bijzonder Solidariteitsfonds, maar in tussentijd zitten onze patiënten zónder behandeling.
Cassiman: ‘En dat terwijl bekend is dat de ziekteverschijnselen van onbehandelde CTX-patiënten voortschrijden. De therapie van Leadiant is voor de patiënten en hun families onbetaalbaar. Er loopt nu een aanvraag tot vergoeding bij het Bijzonder Solidariteitsfonds, maar in tussentijd zitten onze patiënten zónder behandeling.’ CDCA Leadiant kan wel legaal geïmporteerd worden uit Nederland, tegen een kostprijs die schommelt tussen de 14.000 en de 26.000 euro per verpakking van 100 capsules, afhankelijk van de leverancier. Sommige patiënten gaan op het internet op zoek naar CDCA en vonden websites die het product als ‘voedingssupplement’ aanbieden.
En Lucas? Die is intussen een eind in de veertig. Hij kan enkel nog met moeite en veel hulp een zelfstandig leven leiden. ‘In juni 2017 kregen we capsules van de ziekenhuisapotheek van het UZ Leuven’, vertelt zijn moeder. ‘We hadden weer hoop. ‘Tot in oktober 2018 een aangetekende brief werd geleverd. Wij moesten de capsules terugbezorgen, omdat ze mogelijk onzuiverheden bevatten. Dit is verschrikkelijk onrechtvaardig.’ Een broer van Lucas heeft de ziekte ook, maar bij hem kon de diagnose gesteld worden nog voor hij symptomen ontwikkelde. Ook hij nam sinds kort CDCA om symptomen te voorkomen. Ook hij moest de behandeling stopzetten.
(*) Om privacyredenen is ‘Lucas’ een fictieve naam.
Fout opgemerkt of meer nieuws? Meld het hier